新聞及香港科大故事
2023
新聞
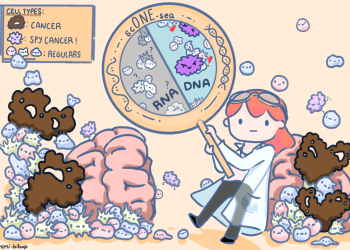
科大突破性發現罕見腫瘤細胞「間諜」 揭示不為人知的癌細胞
香港科技大學(科大)研究人員研發了一種可為冷凍和新鮮細胞組織樣本同時進行單細胞DNA和RNA測序的新技術,更利用這方法識別出偽裝為正常細胞的罕見腦腫瘤細胞「間諜」。是次發現為一些最複雜和罕見腫瘤的研究帶來突破,並為未來的藥物靶標發現開闢新方向。
腫瘤內的不同細胞基因和分子構造(即細胞異變質性)會影響癌症的病理以及腫瘤產生耐藥性的能力,所以在決定癌症治療方法前進行DNA 和 RNA 測序,可以取得有關腫瘤基因和分子組成的重要資訊。由於我們對癌症所知有限,透過分析DNA 和 RNA 測序所產生的更詳細、不同層面的腫瘤分子數據,或可以對有關癌症的謎團,包括腫瘤復發或對治療產生耐藥性的原因提供更多的線索。目前,大部分現成的臨床癌症樣本是來自冷凍生物樣本庫的冷凍組織,這些樣本目前可以用於腫瘤單細胞RNA測序分析,而利用現有技術對這些冷凍組織同時進行單細胞DNA 和 RNA 測序仍有一定的局限。
由科大生命科學學部及化學與生物工程學系副教授吳若昊教授及其博士後研究員于雷博士帶領的團隊開發了一種新型多功能單細胞多組學分析技術scONE-seq。這種技術不僅能分析冷凍細胞及難以取得的細胞類型,如骨骼和大腦;同時也大大簡化了收集腫瘤中的DNA和RNA數據的實驗流程。
星形膠質瘤(Astrocytoma)是一種致命且具擴散性的腦腫瘤,患有此類腫瘤的患者在確診後五年內的存活率僅為 5% 左右。團隊利用其新型單細胞技術,在星形膠質瘤患者樣本中發現了一種細小而獨特的腫瘤細胞亞群。這種獨特的腫瘤細胞群體通過偽裝成大腦的正常星形膠質細胞,逃過使用其他常見腫瘤測序方法的檢測。此外,團隊亦發現這種「間諜」腫瘤細胞具有耐藥性分子特徵;有關「間諜」腫瘤細胞在腫瘤惡化中所起的作用將是未來研究的重要方向。
新聞
解構秀麗隱桿線蟲pri-miRNA加工複合體的分子機制
小分子核糖核酸(microRNAs,以下簡稱miRNAs)是一種在動物和人類基因調控中發揮重要作用的小型核糖核酸(RNA),一直令許多科學家為之著迷。在生物學和醫學中,一項非常重要的研究範疇就是miRNA如何控制和調節基因表達,因為科學界一般相信,這個課題對理解細胞突變有重大作用,對於治療癌症和其他與細胞突變有關的疾病,至為關鍵。
雖然miRNA及其在人類中的生物起源已是科學界的熱門題目,但針對其他動物中的miRNA加工複合體(一種啟動miRNA生物起源的蛋白質複合物)的研究卻相當缺乏。最近,香港科技大學(科大)的研究團隊揭示了秀麗隱桿線蟲加工複合體(cMP)的基本機制,該研究為未來線蟲中miRNA相關研究鋪平了道路,並為探索miRNA在所有生物中發揮的作用,提供更廣泛的視覺。
該研究最近在開放獲取期刊Nucleic Acids research上發表。
領導這項研究的科大生命科學部助理教授阮俊英教授說:「秀麗隱桿線蟲加工複合體(cMP)的分子機制自18年前發現以來,一直沒有詳細闡明。當然,出於充分的理由,許多人關注於人源miRNA的研究,但是對於秀麗隱桿線蟲中這種複合體卻缺乏基本信息,所以引發了我們的研究。」

新聞
隱藏深海的熱浪對珊瑚礁構成威脅
2019年四月至五月,位於南太平洋中部法屬坡利尼西亞莫雷阿島一帶的珊瑚礁經歷了長時間且嚴重的高溫白化。由於該年並非厄爾尼諾年份,一般並不會出現這種情況,因此本事件令全球海洋科學界百思不解。
由香港科技大學海洋科學系艾力克斯・懷亞特(Alex Wyatt)助理教授領銜的國際團隊對這宗不尋常的珊瑚白化事件展開了調查。 研究人員發現,這次災難與反氣旋渦流的通過有關。該渦流使該區域海平面升高,並使溫度較高的海水集中在珊瑚礁上,進而導致海洋熱浪大規模地隱藏在水面之下。 團隊的研究成果最近於《自然通訊》(Nature Communications)期刊上發表 。
過往關於珊瑚白化模式的研究,大多數仰賴於海水表面溫度的測量。以這種方法收集數據,並未能全面了解海洋溫度升高對海洋生態系統、乃至對熱帶珊瑚礁的威脅。雖然以衛星大範圍的海表溫度監測資料有其重要用途,卻不能協助科學界監測海面數米以下區域的熱能,亦無法探究在水表面之下,熱能變化如何影響生態群聚。
新聞
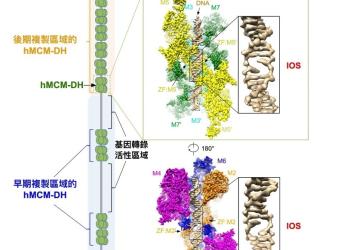
研究揭示DNA解旋機制 為癌症治療帶來新曙光
香港科技大學(科大)聯同香港大學(港大)與法國居禮研究所共同發現了人體MCM2至MCM7蛋白複合體(Minichromosome Maintenance 2-7,微小染色體維持蛋白2-7)調控DNA 複製起始(Replication Initiation)的新機制。 此發現可被應用於研發新型、高效及更具針對性的抗癌藥物。這項研究成果現已刊登在國際頂尖科學期刊《細胞》雜誌上(按此瀏覽期刊文章)。
我們的生命由單個受精卵細胞形成時開始。在母體子宮內,受精卵通過細胞分裂而發育成多細胞個體。在每次分裂中,編碼遺傳信息的基因組DNA都會被準確複製。每個細胞攜帶的DNA總長度約為兩米,其通過摺疊、整合成為23對染色體。在人的一生中(約70年),人體將合成接近一光年長度的DNA(10^16米)。在複製的過程中,首先須利用解旋酶將雙鏈DNA分解成兩條單鏈DNA,其後DNA聚合酶以此為模板,合成兩條新的互補配對的雙螺旋DNA。若調控過程中出現一絲紊亂,都可能導致嚴重後果,例如腫瘤或遺傳疾病等。
「破解DNA複製的機制是認識生命奧秘的關鍵。」領導這項研究的港大生物科學學院助理教授翟元樑博士說。「而解析複製機器蛋白質結構是了解其分子功能最核心的步驟,因為只有親眼看到,才能相信。」
2022
新聞
研究發現促進成年神經系統軸突再生的內在免疫機制
中樞神經系統一旦受創,例如在脊髓損傷的意外中,傷者很可能會永久喪失感覺或活動能力,當中的關鍵原因,是軸突斷裂後無法再生。目前,醫學界為脊髓損傷患者恢復活動能力的方法非常有限。若要為他們帶來治療希望,其中一個 研究方向,便是要破解令這些受傷軸突再生的方法。
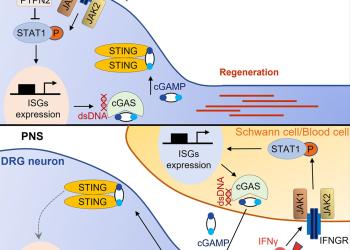
由香港科技大學(科大)生命科學部鄭氏理學副教授劉凱帶領的團隊,用老鼠進行實驗,解構了促進神經突軸再生的部分原理。他們發現,通過敲除神經元內編碼一種磷酸酶的基因PTPN2,可以促進中樞神經系統的軸突重生,另外,若再外加Ⅱ型干擾素IFNγ,更可進一步提升再生的軸突數量和生長速度。這項研究的結果,最近於科學期刊Neuron上發表。
人類的神經系統可分為兩部分:中樞神經系統和外周神經系統。與中樞神經系統的分別是,外周神經當受到損傷時,具有較強的再生和自我修復能力 。不過,科學界一直並未完全了解這個再生和修復過程與神經系統內在免疫機制以及免疫相關的細胞因子的關係,包括一些信號通路如何影響受傷的神經元,以及它們能否直接促進軸突再生。
是項研究亦探索了IFNγ-cGAS-STING信號通路有否參與外周神經的自我修復過程。團隊發現,外周神經軸突可以在損傷後,直接調節其損傷環境中的免疫反應,以促進自我修復。
在過往的研究中,劉教授的團隊已經發現,可以通過提高神經元電活動,改變神經元甘油脂代謝途徑等不同方法,從而加強軸突的再生能力。今次這項研究,為脊髓損傷這類情況的未來治療方案,找到進一步線索,比如聯合幾種不同的信號通路可以大幅提高神經再生。

新聞
科大團隊開發一種新型集成方案實現 III-V半導體器件和矽組件之間的有效耦合
香港科技大學的研究人員最近發明了一種新型集成方案,透過選擇性直接外延技術1,在矽光子平台上開發了III-V族化合物半導體器件和矽元件的高效耦合—,釋放集成高能效光子和低成本電子的潛能,令下一代通信 可以低成本、更高速和更大容量的方式呈現。
近年,在大資料、汽車、雲端和感測器等各種應用和新興技術的推動下,資料流程量呈指數級增長。為了解決資料通信的瓶頸,矽光子學成為一項被廣泛研究的核心技術,通過節能、大容量和低成本的光互連實現資料傳輸的增長。雖然矽基無源組件已經在矽光子平台上成熟的建立,但雷射器和光電探測器並不能由矽製成,需要在矽上集成其他材料,例如 III-V 族化合物半導體等。
現時對於矽上的 III-V 雷射器和光電探測器主要通過兩種方法進行了研究。第一個是以鍵合為基礎的方法,儘管此方法已能產出了性能很好的器件,但要求複雜的製造工藝,而且成本高、產量低,使大規模生產變得非常具挑戰性。另一種方法是通過在矽上縱向生長多層 III-V 的直接外延方法,雖然它提供了一種成本更低、可擴展性更大和集成密度更高的解決方案,然而這種方法中所必須用到的幾微米厚的 III-V 緩衝層阻礙了 III-V 和矽之間的有效光耦合,因此解決這一問題成為了集成矽光子學的關鍵。
為解決這一關鍵問題,由香港科技大學電子及計算器工程學系榮休教授劉紀美領導的團隊開發了橫向選區生長技術—一種新穎的選擇性直接外延方法,可以選擇性地在矽上橫向生長 III-V 材料,而無需緩衝層。此外,基於這項新技術,該團隊亦設計並實現了 III-V 光電探測器和矽組件的獨特面內集成,並在 III-V 和矽之間具有高耦合效率。與商用光電探測器相比,這種方法實現的光電探測器雜訊更小,靈敏度更高,工作範圍更廣,且具有超過 112 Gb/s的高速—較現有產品更快。這不但乃首次通過直接外延的方法實現III-V 器件與矽組件的有效耦合,而且可以應用於各種 III-V 器件和矽基元件的集成,從而實現在矽光子平台上集成光與電模組以進行數據通信的最終目標。

新聞
科大團隊破解幹細胞變化之謎 為抗衰老研究邁進一大步
古今中外,「抗衰老」一直都是歷史和文學中的熱門題材。從中國古代的秦始皇派員遠征大海尋找長生不死之藥,到西方小說中的德古拉伯爵擁有不死之身,千百年來,人類仍沉醉於尋找不老之術,至今仍未有解決方法。
最近,由何善衡生命科學教授席生命科學部副教授張曉東教授領導的一個研究小組,在抗衰老研究上獲得了突破性的進展。
張教授一直專注於研究肌肉幹細胞。肌肉幹細胞在人體的肌肉修復過程中,起著關鍵的作用,而團隊發現了一種方法,可基於染色質的特徵識別出老化的肌肉幹細胞。衰老的肌肉幹細胞與年輕的不同,它們的幹性會降低,也就是說它們成為新幹細胞或變成特定細胞以替代受損組織的能力會降低。在下一步的研究中,如果能再找到方法將這些衰老細胞的染色質特徵修改,將它們變得與年輕細胞一樣的話,那麼細胞衰老、以致骨骼肌組織衰老的過程便有望暫停,甚至逆轉。
團隊的研究成果最近於Cell Press 出版的公開期刊 iScience 中發表。
張教授認為,調控染色質的開放程度及可及性是決定細胞命運的關鍵。他闡釋說,染色質狀態的變化可導致基因表達失調。今次的研究顯示逐漸激活的染色質狀態是幹細胞衰老的重要標誌,而這項發現很可能成為未來研發抗衰老技術的一個重要方向。
染色質是一種包裹在組蛋白周圍的 DNA 複合物,用於維持 DNA 的正常結構,而它們的結構會隨外部環境迅速變化。承接以往研究所得,團隊今次在老鼠體內預先固定了肌肉幹細胞的狀態,以取得靜息細胞(平時在休眠狀態, 但在肌肉受傷時會激活,以發揮修復功能)以及它們的基因和染色質特徵,再隨著時間變化,比較染色質的「可及性」。
研究的第一作者董安琪博士指出:「我們發現年輕肌肉幹細胞的染色質環境,在靜息狀態會變得非常緊密,並在激活初期有較高的『可及性』。它們在長期的再生過程後,會逐漸重新建立緊密狀態。然而,老化的肌肉幹細胞在靜息期間,則不能維持染色質的緊密環境。」董博士是張教授研究團隊的前成員,現為布魯塞爾自由大學博士後研究員。







