新聞及香港科大故事
2022
新聞
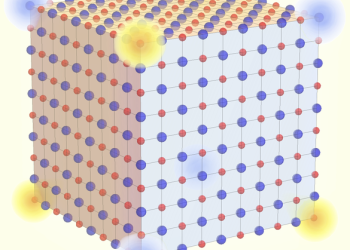
科大共同研究發現食鹽的拓撲特性及其角落電荷
粵語中有「我食鹽多過你食米」一說。雖然言者未必有意聽者亦無須太認真,但這句俗語卻的確帶出了「食鹽」在我們日常生活中的重要性。而你又可有想過,守候在餐桌角落,重要卻不起眼的食鹽,竟然會與前沿物理研究及抽象數學理論扯上關係呢?
香港科技大學(科大)與東京大學的研究團隊近日發表共同研究,證明了食鹽(氯化鈉)的離子晶體結構具有拓撲學意義上的不平庸性,意即食鹽立方晶體的角落實帶有不尋常的分數電荷。這個研究證明即使是結構簡單的離子化合物,亦可能具有新穎的拓撲材料特性。而這些先前未被發現的拓撲特性,可能會為我們對結晶體的形成與溶解的微觀過程帶來更佳的理解,亦可能同時為微型量子導體的研發開拓出新方向。
我們的日常生活隱藏了大大小小、形形色色的先進材料。就以智能手機為例,在鋁合金外殼和強化玻璃螢幕中的小小空間,便收藏了包含金、銀、銅、錫等金屬以及玻璃、雲母等絕緣體的電路板,還有建基於半導體技術的微處理器等等元件。人類利用了特性迴異的各式材料,創造出日新月異的電子設備,但大自然卻早以更精巧的手法,把相反的物理性質結合在單一材料之中。而這些新奇的材料,在學界被稱為「拓撲材料」。
作為一個數學概念,拓撲學的主要目的是理解及探索抽象空間和物質在特定改變之下(例如拉扯、壓迫或彎曲),具有甚麼不變的特性。舉個例子,即使我們扭曲、拉扯一件毛衣,或這件毛衣縮了水,只要我們不把毛衣撕破,它還是有四個開口:頸項、雙手和腰部。假如我們把毛衣替換成連帽衞衣以至運動背心,它們的開口數目同樣維持在四個。從拓撲學的角度而言,這些衣物是一樣的。物理學家近年發現拓撲材料的電子特性亦不合常規,譬如說,拓撲材料的內部是不導電的,但在其外圍的薄薄一層原子卻必然導電。它們不能被簡單定義為絕緣體或導電體,而是結合兩者的自然產物。拓撲材料的新奇特性讓科學家着迷,當中二維材料石墨烯可以說是與生活應用最接近的一員,其他的拓撲特性一般都只能在少數不常見或難以合成的材料中實現。
新聞
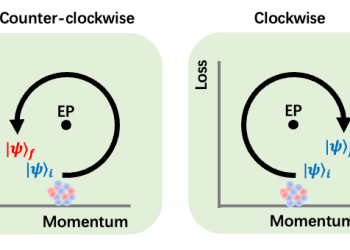
科大學者發現利用損耗實現量子控制的新方法
香港科技大學(科大)的研究人員發現一個新方法,利用粒子損耗這種在量子器材中通常需要避免的過程來控制量子態,有機會能為實現前所未有的量子態開闢新的途徑。操控量子系統需微妙地掌控量子態,不能有絲毫不完美的運作出現,否則量子態中的有用信息會被擾亂。其中,有份組成系統的粒子出現損耗,乃掌控量子領域中面對最普遍而重大的挑戰。科學界一直透過孤立系統來避免這個問題。惟現在,科大的研究人員發現了一種能通過原子量子系統中的損耗來控制量子的方法。這項發現近日於《自然物理》雜誌上發表。負責這項研究的科大物理學Hari Harilela副教授曹圭鵬表示,研究結果顯示「損耗」有潛力成為量子控制的開關。「量子力學的教科書指出,只要把系統從環境中有效分隔開來,系統便不會受粒子損失的影響。然而,不論是傳統系統抑或量子系統,開放的系統總是無處不在。而正如非厄米特物理學理論所形容,這樣的開放系統呈現了很多有違直覺,以及無法在厄米系統中觀察到的現象。」含損耗的非厄米物理學在傳統系統中早已得到充分的探討,但直到最近,這種有違直覺的現象方在真正的量子系統中得被觀察得到且加以實現。在這次研究工作中,科大的研究人員改變了系統的參數,沿著特殊點(亦即非厄米系統中的奇異點)周圍建立了一個閉環路徑,發現了閉合路徑旋轉的方向(例如順時針或逆時針),能決定最終的量子狀態。該團隊的另一位負責人,科大物理學系李贊恒教授表示:「這種跟手性有關的特性﹕即圍繞奇異點、由方向決定的量子態轉化,可以是量子控制的一個重要組成部分。我們現正站立於控制非厄米量子系統的起始點。」
2021

新聞
科大合辦APCIEE促進創新文化(只供英文版本)
The Association of Pacific Rim Universities (APRU) and the Division of Public Policy (PPOL) at the Hong Kong University of Science and Technology (HKUST) hosted the Asia-Pacific Conference on Innovation and Entrepreneurship Ecosystems (APCIEE) on 6-7 December 2021. The conference invited 31 experts from all over the world to share their experiences in the creation of successful innovation hubs with over 180 attendees (in-person and online), which helps cultivate an innovation network of Hong Kong with aligned interests.

新聞
科大與浸大研究團隊聯手破解深海帽貝群體連通性
香港科技大學(科大)與香港浸會大學(浸大)的研究人員合作,首次破解一種廣泛分佈於西北太平洋深海熱泉(hydrothermal vent) 與冷泉區(hydrocarbon seep)的深海帽貝的種群歷史、遺傳結構,以及群體連通性。這項研究不僅有助我們了解深海生物在棲息地、地形,與洋流互相影響下的遷徙規律、分佈歷史,以及當代基因流,更可為保育海洋生物多樣性及制定環境管理策略提供重要科學依據。
20世紀70年代末至80年代初深海熱泉與冷泉區的相繼發現,極大地改變了人類對地球上生命進化過程的認知。與主要由光合作用驅動的陸地及淺海生態系統不同,深海熱泉與冷泉這種黑暗、高壓,並經常伴有高濃度有毒物質的生態環境則主要由化能合成作用驅動。它們廣泛分佈於地殼運動活躍區,並孕育了多樣生命,形成了宛若深海「荒漠」裡的「生命綠洲」。然而,隨著日趨深入的海洋考察及研究,科學家發現一些物種在深海熱泉與冷泉區均有分佈,而當中更是相距數百至數千公里。這些發現不禁引人深思:這些深海生物如何實現基因交流?不同生物群落之間是否存在遺傳差異?
為了深入探討這些科學問題,科大海洋科學系講座教授暨系主任錢培元與浸大生物系教授邱建文率領本港團隊,並連同中國海洋大學及日本國立研究開發法人海洋研究開發機構的海洋生物學家,運用群體遺傳學分析與物理洋流模型,系統地研究了一種廣泛分佈於西北太平洋熱泉與冷泉區的深海帽貝的種群歷史、遺傳結構,以及群體連通性。
通過群體遺傳學分析,研究團隊首次揭示深海帽貝在西北太平洋分為四個亞群,包括一個深海熱泉亞群與三個冷泉亞群。研究人員進行種群歷史分析,進一步推衍出深海帽貝這四個亞群形成的歷史過程:最初深海帽貝分為兩個冷泉亞群分支,並分別棲息於較淺水的黑島海丘(Kuroshima Knoll)冷泉區及較深水的冷泉區域。少數屬於黑島海丘冷泉區的帽貝幼體後來隨著太平洋洋流「黑潮」(Kuroshio Current) 的歷史遷移而進入沖繩海槽,牠們逐漸適應沖繩海槽熱泉區的環境,並形成熱泉亞群;而分佈於較深水的南海蛟龍海脊冷泉區與相模灣冷泉區,則逐步分化為兩個較深水亞群分支。該遺傳分化可能與呂宋海峽的地理阻隔及南海蛟龍冷泉區近兩千年來的甲烷通量下降有關。