新闻及香港科大故事
2024

新闻
科大举办「分子前沿研讨会」 汇聚四名诺贝尔奖得主 激发年轻一代科创热情
香港科技大学(科大)今天起一连三日于大学的逸夫演艺中心举办「分子前沿研讨会」(Molecular Frontiers Symposium),邀得多位国际知名科学家,包括四名诺贝尔奖得主出席演讲,为一众顶尖学者及年轻新一代,提供多元化思想领袖平台,促进交流与联系。
来自世界各地近40名国际顶尖分子科学家,包括诺贝尔奖得主斯特凡‧赫尔(Stefan HELL) 教授、蒂姆‧亨特(Tim HUNT) 爵士、卡尔‧巴里‧夏普利斯(K. Barry SHARPLESS) 教授和格雷戈里‧温特(Gregory WINTER) 爵士,将于大中华区首届题为「科学新知的前沿」的研讨会上,就基因编辑、萤光显微镜及蛋白质工程等议题,分享真知灼见及相关领域的最新发展。
研讨会录得逾1,500名报名参与嘉宾,当中包括数百名来自香港和其他大湾区城市的学生,以及生物科技与生物医学范畴的专家和业界代表等。在研讨会的答问环节上,与会同学向现场的顶尖讲者踊跃提问,了解他们于研究路上所面对的得与失。各讲者分享他们的独到见解和心得,为有志投身科研创新的学生带来启发。
活动主办方分子前沿基金会(Molecular Frontiers Foundation)创会主席Bengt NORDEN 教授表示:「分子前沿研讨会旨在激发下一代对科学的热情,推动分子科学的创新研究,并促进顶尖科学家与大众之间具意义的互动。我们很高兴是次盛会首次在香港举行。香港是一个充满活力的国际教育枢纽,拥有五所位列全球百强的大学,而科大是当中一所致力于创新与研究的大学。透过于科大汇聚这批卓越的学者,我期望能激发富有成果的讨论并促进跨地域合作,从而帮助塑造分子科学的未来。」
2022
新闻
科大研究人员在前所未有的深度实现了小鼠大脑皮层近无创活体成像
香港科技大学(科大)的一个研究小组首次实现穿过完整的小鼠头骨在脑膜下方750微米这一前所未有的深度,对小鼠大脑皮层内的微小神经结构進行活体成像。这一研究能够以接近无创的方式在大脑皮层中进行高分辨成像,将进一步促进大脑科学的研究。
对活体大脑中神经元、神经胶质细胞和微血管系统進行直接而非侵入式成像对于增强我们对大脑功能的理解至关重要。近几十年来,人们一直致力于开发用于完整大脑活体成像的新技术。然而,超声成像(超声)、正电子发射断层扫描(PET)和磁共振成像(MRI)等等現行技术都无法提供足够的空间分辨率来对亚细胞水平的生物结构进行可视化。
虽然三光子显微技术(3PM)等光学显微技术可以对活体样本的结构和功能信息进行高时空分辨率显微成像,然而,当光穿过不均匀的生物组织并与其相互作用时,就会产生光学像差和散射,这从根本上限制了光学显微镜在分辨率和成像深度上的性能。
要矫正像差并恢复光学显微镜在活体成像时的分辨率,自适应光学(AO)有希望成为一种解决方案,但它并非没有缺点:当成像深度增加时,用于传统波前传感的导星信号会迅速消失。
在电子与计算机工程系教授瞿佳男教授和生命科学系首席教授叶玉如教授的共同领导下,科大的研究团队最近开发了一种结合了3PM和两种AO技术的显微镜,实现了对组织深处中低阶和高阶像差的快速测量和校正。
该系统利用了两种 AO 技术:基于相敏感方法直接测量焦点电场分布技术和遥距调焦共轭自适应光学技术(CAO)。通过对导星信号进行编码再解码,该方法实现了对像差的快速AO测量和校正。这一方法能够准确测量激光在组织中带像差的电场点扩散函数,同时快速校正大脑中大成像体积内的像差。
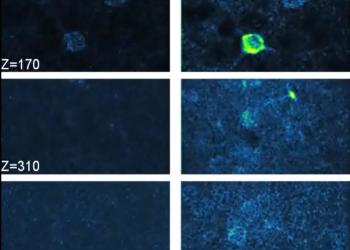
该团队使用 1300 納米的激发波长验证了 AO-3PM 系统的成像性能,实现了穿过完整的头骨在活体小鼠和体外试剂上成像。结果表明,AO-3PM 实现了高空间分辨率,在大脑深处显著提升了荧光信号,并在软脑膜下方高达 750 微米的深度对小鼠大脑皮质进行了高分辨率的结构和功能成像。
2021

新闻
科大研发简单血液测试 及早检测阿尔兹海默症
由香港科技大学(科大)领导的一支国际研究团队,成功利用中国人群患者数据,研发出首个简单而可靠的血液检测方法,能及早筛查并识别阿尔兹海默症(AD)患者,准确率逾 96%。目前医生对于 AD 患者的诊断主要依靠对患者认知能力的测试,至于就 AD 病情的病理评估,最常使用的医疗程序是以脑部成像和腰椎刺穿术来侦测由 AD 引起的大脑病变。但有关方法费用昂贵、具侵入性,亦未有于世界各地获广泛应用。现在,由科大副校长(研究及发展)叶玉如教授领导的研究团队,从 429 种与 AD相关的血浆蛋白中,识别出 19 种具有 AD 患病特征的血浆蛋白生物标志物组群。团队根据这组标志物,设计了一套评分系统,可将 AD 患者自健康人群中区分出来,其准确率超过 96%。该系统还能辨别 AD 早、中及晚期三个阶段,可用作监测患者的病情发展。身兼科大晨兴生命科学教授及分子神经科学国家重点实验室主任的叶教授表示:「基于先进的超灵敏血液蛋白检测技术,我们成功开发了这套简单、无创而精准的 AD 诊断方法,将为AD的大规模筛查及分期诊断提供重大助力。」这项研究由科大与伦敦大学学院研究团队,以及来自包括威尔士亲王医院和伊利沙伯医院等本地医院的临床医生合作进行。团队利用尖端的超灵敏高通量邻近延伸分析技术(PEA),从香港 AD 患者所收集的血浆样本当中,检测了逾 1,000 种蛋白质的水平变化情况,从而取得是次研究成果。这项令人振奋的发现令高效的 AD 血液检测技术得以诞生,并为开创新型 AD 治疗方法打下基础。作为迄今为止就 AD 患者血液蛋白方面最全面的研究,有关结果近日被国际权威科学期刊 Alzheimer's & Dementia: The Journal of the Alzheimer's Association 刊载,并在不同 AD 研究和学术交流平台,包括 Alzforum,获得热烈的关注和讨论。据统计,全球罹患AD的人口数目已超过 5,000 万。患者会丧失脑细胞,并岀现一系列脑功能及认知功能障碍,包括丧失记忆,以及出现行动、推理和判断能力受损等症状。然而,尽管 AD 早在症状出现前至少 10-20 年已对患者大脑产生显著影响,患者却往往只在记忆出现问题时,才会寻求医生诊治。
2020

新闻
科大发现阿尔茨海默病治疗新靶标
香港科技大学(科大)研究团队设计了一个研究大脑的崭新方法,不但有助评估潜在药物对阿尔茨海默病(AD)患者的作用,更因而发现了治疗AD的新靶标,为阿尔茨海默病的研究及药物开发开辟新路径。
叶玉如教授 (左二)及其研究团队。
阿尔茨海默病的病理机制研究已开展了数十年,但至今仍未有有效的治疗方法。传统的研究方法在判断分子靶标是否可应用于药物开发方面存有一定的局限性。例如在分子和病理研究中,AD患者脑部会被当作一个整体进行分析,但不同类型的脑细胞以及其异变对AD的作用,却往往因此而被忽视,尤其是一些数量较少、例如仅占脑细胞总数5%的小胶质细胞及1%的内皮细胞等。
由科大研究与发展副校长、分子神经科学国家重点实验室主任及生命科学部晨兴教授叶玉如领导的研究团队,近日不仅解决了这个问题,更同时在内皮细胞和小胶质细胞发现了多个潜在的新分子靶标,可用于开发治疗AD的药物。
叶教授的团队利用先进的单细胞转录组分析技术,分析AD患者遗体大脑中特定细胞的功能。这项技术让研究人员在单细胞水平上追踪传统工具无法观测到的大脑分子变化。研究团队对AD患者大脑中特定细胞的转录组变化作了全面分析,找到与AD相关的细胞亚型和病理途径,并发现在大脑血管中内皮细胞亚群的作用。研究首次发现血管自然的增新程序和内皮细胞亚群中的免疫启动与AD的发病机理有关连,显示血管失调与阿尔茨海默病之间存在联系。研究还发现了新型分子靶标,有助恢复AD患者的神经动态平衡。
2019

新闻
香港科大共同研发推迟受损神经退化新机制
由香港科技大学(科大)、中国科学院(中科院)及暨南大学组成的研究团队,最近发现一个可推迟受损神经退化的新机制,为治疗神经损伤及神经退行性病变如柏金森症、肌萎缩性脊髓侧索硬化症(俗称渐冻人症)等带来新希望。轴突是神经元/神经细胞延伸出的细长突起,负责传导讯息予肌肉及其他神经细胞。一直以来,神经元之间长度达数米的神经可如何维持其完整性,是神经科学中的重要问题之一。 一旦轴突不能维持完整,将导致轴突死亡与神经退化,这种情况非常类似如本次研究所针对的神经受损而引起的瓦勒氏变性。多年来,NMNAT相关通路是已知唯一能抑制瓦勒氏变性导致的受损神经退化的机制。然而,是次由科大生命科学部郑氏理学副教授刘凯教授、中科院上海有机化学研究所生物与化学交叉研究中心方燕姗教授,以及暨南大学粤港澳中枢神经再生研究院李昂教授合作的研究,发现了一个全新的可推迟受损神经退化的蛋白Vps4。该研究成果已于科学杂志《Science Advances》上发表。团队通过对果蝇的基因筛查及其后在老鼠上的验证,发现上调Vps4的表达量,于离体细胞实验或老鼠在体实验都能有效推迟受损神经退化,在体实验可达3天。这一发现对理解轴突完整性的调节及神经退化分子机制方面是一个重大突破。此外,与NMNAT机制不同的是,Vps4还具有调节自噬功能— 即一个清除受损蛋白质和细胞器以对抗损伤及衰老对神经退化所构成的负面影响的机制。因此缺失Vps4将引发自噬功能障碍,并导致日后的轴突退化。

新闻
新研究中心成立助脑退化患者
香港科技大学(科大)与哈佛大学医学院的教学医院波士顿儿童医院(哈佛)、史丹福大学医学院的保罗·F·格伦衰老生物学中心(史丹福)及伦敦大学学院(UCL)今日签署具有里程碑意义的合作备忘录,就前沿转化神经科学研究展开合作。香港特别行政区行政长官林郑月娥女士、科大校董会主席廖长城先生、科大校长史维教授、创新及科技局局长杨伟雄先生,以及外交代表包括英国驻港总领事贺恩德先生等亲临见证签署仪式。
这份合作备忘录标志着四大知名院校迈向重要战略性合作的第一步,共同展开前沿创新的转化神经科学研究。四所院校决定成立「神经退行性疾病研究中心」(中心),并联合申请Health@InnoHK创新平台项目。中心将为科大、哈佛、史丹福和UCL的科学家构建一个协同创新平台,整合各方优势,开展跨学科的、具重大社会影响的研究。
香港特别行政区行政长官林郑月娥女士表示﹕「是次合作汇聚四所全球三大洲最顶尖的大学,在共同促进香港医学研究上立下一个重要的里程碑。我希望四所院校能结合其科学家及研究人员的专业知识与热诚,为神经退化性疾病的诊治带来重大进展。」
科大校董会主席廖长城先生对特区政府大力推动科研的决心表示感谢,他说:「政府投入大量资金和精力,为香港的创科发展营造有利环境。作为一所世界级的研究型大学,科大很荣幸、亦有责任为顶尖的科研人员搭建平台,为本港健康卫生领域作出贡献。我期待中心在不久的将来能取得重大突破性成果。」
科大校长史维教授表示:「是次合作无疑将推动神经退行性疾病机制及其诊疗方法的研究,这对于我们应对全球面临的人口老龄化问题至关重要。」
中心将主要集中研究阿尔兹海默症﹕一种最常见的神经退化性疾病,是导致老年人死亡的十大原因之一。这种不治之症正影响全球近4700万人口。现时全球面临人口老化危机,预期患者数量未来将急速增加,至2050年将达1.3亿。阿尔兹海默症不但对患者及其家人带来沉重的经济和精神负担,而且对医护成本及生产力亦构成重大压力,给社会经济带来严重损失。香港作为全球最长寿的地区之一,预计至2050年有39%的人口将达65岁或以上,也必将面临阿尔兹海默症带来的冲击。