香港科技大学(科大)的研究人员发现了干细胞微环境如何控制干细胞分化为各种功能性细胞,这对于未来利用干细胞治疗各种人类疾病具有重要意义。
人体干细胞拥有独特的能力,可以复制和分化为特定的组织细胞,从而支持人体正常发育和维持组织功能运作。基于这种特性,干细胞具有潜力将受损或患病的细胞替换为健康的细胞,用于治疗柏金逊症、阿尔兹海默症及1 型糖尿病等疾病。
虽然干细胞具有治疗人类疾病的潜力,但开发干细胞疗法并不简单。其中一个挑战在于如何有效地将干细胞分化为具有不同功能的细胞,以替换退化组织中的受损细胞。干细胞周围的组织(即干细胞微环境)对干细胞分化成功能性细胞起着控制作用,但科学家对其中的分子机制了解有限,这使得这一任务更加困难。
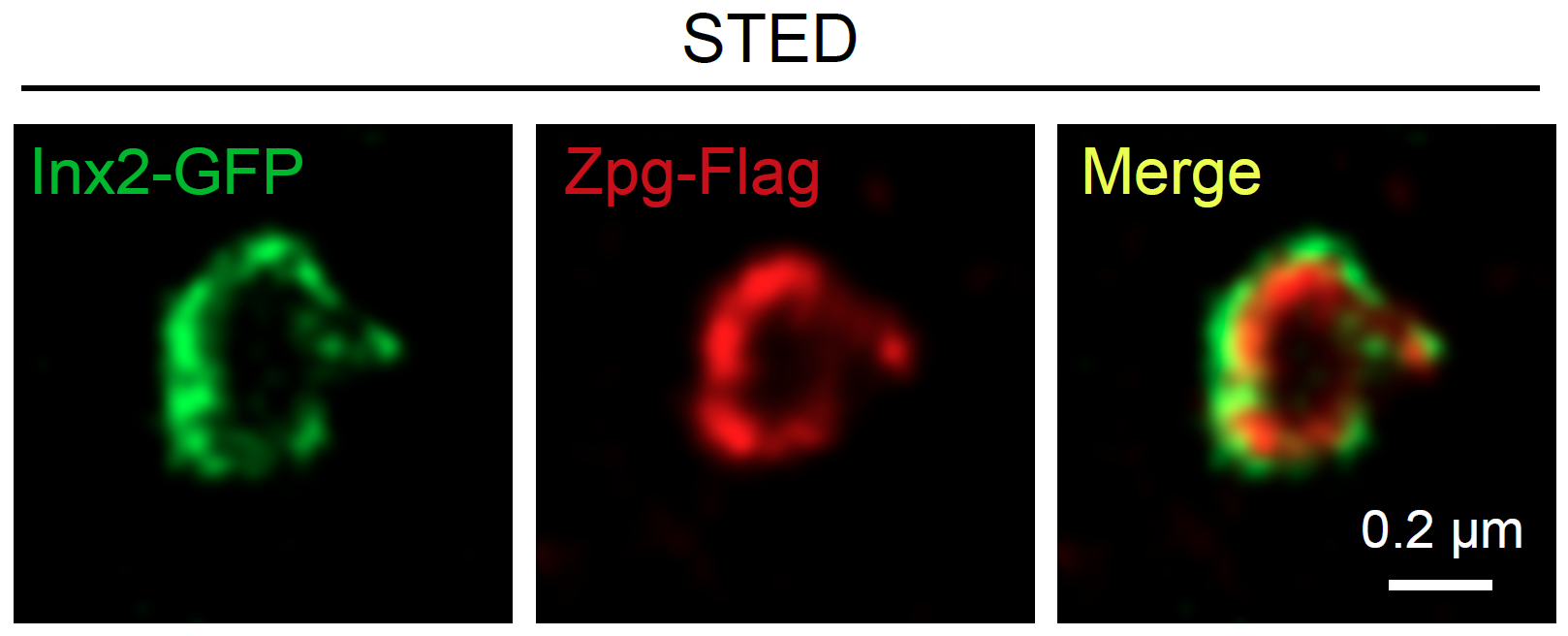
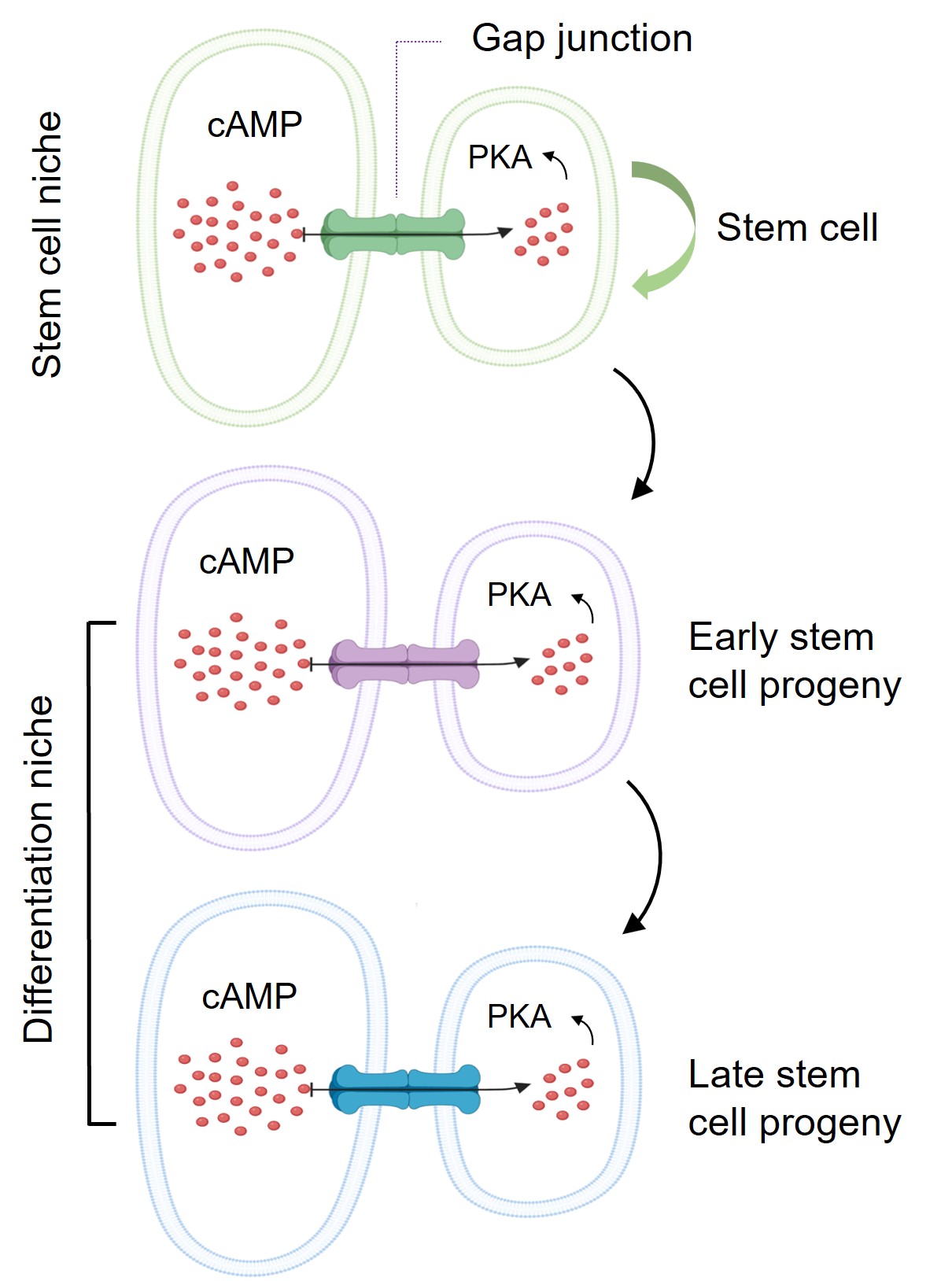
近日,科大生命科学部主任及讲座教授解亭所带领的团队首次发现,干细胞微环境利用一种称为「间隙连接」(Gap junction)的蛋白通道,将干细胞微环境内的第二信使(Secondary messenger )cAMP传送到干细胞及其子代细胞,以控制其分化过程。作为细胞内最重要的第二信使,cAMP负责调节多个细胞功能,包括干细胞的分化。
本身亦为嘉里理学教授的解教授选择果蝇卵巢作为实验模型,研究了两种干细胞微环境如何分别控制干细胞自我复修和分化过程。
透过了解干细胞微环境的调节机制,有助我们引导干细胞分化为适当的细胞类型,以移植到已退化的人体组织。另外,退化性疾病一般会破坏干细胞微环境和干细胞,因此了解干细胞微环境的调节机制也有助于重建干细胞微环境,以移植并帮助干细胞分化为功能性细胞。
解教授表示:「这些发现推动了干细胞生物学和再生医学的知识前沿,为将来应用干细胞治疗各种人类疾病奠定了基础。未来,我们将会研究人类干细胞微环境是否同样利用「间隙连接」(Gap junction)传送cAMP,以控制干细胞分化为功能性细胞,进一步进行修复。除此以外,我们还会尝试从干细胞微环境中,揭示其他经「间隙连接」通道传送至干细胞及其子代细胞的分子。 」
有关研究是由科大及美国斯托尔斯医学研究所(Stowers Institute for Medical Research)的研究人员合作完成,最近于国际学术期刊《美国国家科学院院刊》(Proceedings of the National Academy of Sciences)上发表。研究团队包括科大生命科学部研究助理教授屠仁军博士及本科生汤笑寒和徐蕤,此外还包括斯托尔斯医学研究所的平兆华博士和余祖林博士。