科大發現阿爾茲海默症治療新靶標
香港科技大學(科大)研究團隊利用了一個研究大腦的嶄新方法,不但有助評估潛在藥物對阿爾茲海默症(AD)患者的作用,更因而發現了治療AD的新靶標,為阿爾茲海默症的研究及藥物開發開闢新路徑。

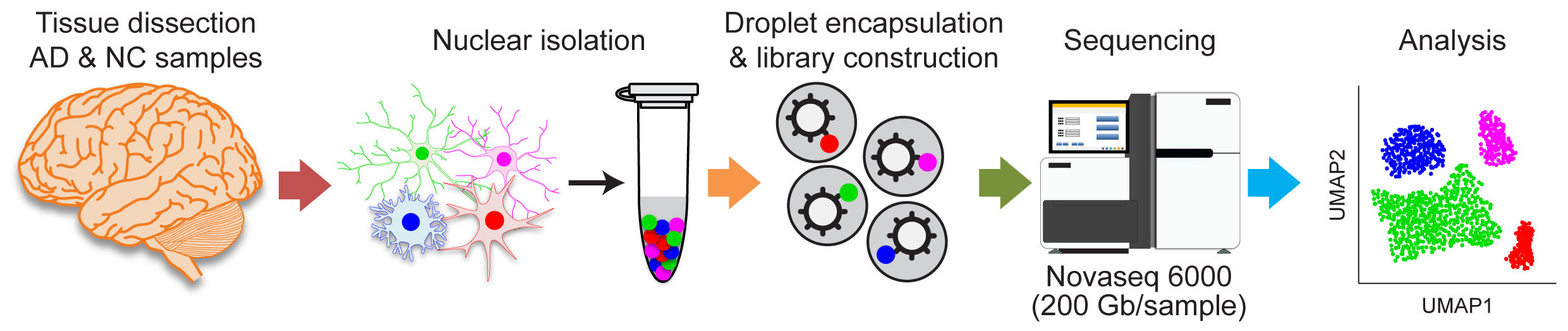
阿爾茲海默症的病理機制研究已開展了數十年,但至今仍未有有效的治療方法。傳統的研究方法在判斷分子靶標是否可應用於藥物開發方面存有一定的局限性。例如在分子和病理研究中,AD患者腦部會被當作一個整體進行分析,但不同類型的腦細胞以及其異變對AD的作用,卻往往因此而被忽視,尤其是一些數量較少、例如僅佔腦細胞總數5%的小膠質細胞及1%的內皮細胞等。
由科大研究與發展副校長、分子神經科學國家重點實驗室主任及生命科學部晨興教授葉玉如領導的研究團隊,近日不僅解決了這個問題,更同時在內皮細胞和小膠質細胞發現了多個潛在的新分子靶標,可用於開發治療AD的藥物。
葉教授的團隊利用先進的單細胞轉錄組分析技術,分析AD患者遺體大腦中特定細胞的功能。這項技術讓研究人員在單細胞水平上追蹤傳統工具無法觀測到的大腦分子變化。研究團隊對AD患者大腦中特定細胞的轉錄組變化作了全面分析,找到與AD相關的細胞亞型和病理途徑,並發現在大腦血管中內皮細胞亞群的作用。研究首次發現血管自然的增新程序和內皮細胞亞群中的免疫激活與AD的發病機理有關連,顯示血管失調與阿爾茲海默症之間存在聯繫。研究還發現了新型分子靶標,有助恢復AD患者的神經動態平衡。

此外,團隊亦利用相關技術分析了細胞因子白介素33(IL-33)的作用機制。IL-33是重要的免疫訊號蛋白,有機會發展成為有效治療AD的新藥物。研究人員發現,IL-33可以通過刺激小膠質細胞特定亞型的生長,促進對澱粉樣蛋白的清除,從而改善阿爾茲海默症的病理特徵。團隊更在小膠質細胞轉化為一個負責去除病原體的吞噬狀態機制方面,取得了突破性成果。
葉玉如教授表示:「要深入剖析疾病發病機制的困難之處,主要在於大腦細胞組成非常複雜。單細胞技術的發展為我們提供了更好辨識分子靶標的新工具,有助推動阿爾茲海默症新療法的開發。」
研究成果已在國際權威科學期刊《美國國家科學院院刊》(PNAS)和《細胞報告》發表。
阿爾茲海默症是一種常見的腦部退化性疾病,目前全球患者人數已超過五千萬,預計到2050年將會增加至一億五千多萬。阿爾茲海默症的病理學標志包括在患者腦部出現澱粉樣(Aβ)蛋白的沉積和神經原纖維纏結,如果這些異常蛋白長時間積聚,會導致細胞功能障礙,出現記憶力喪失,溝通困難,身體能力下降等症狀,最終導致死亡。