科大研究團隊共同發現內質網融合蛋白新功能 為了解遺傳性痙攣性下身麻痺病理提供新見解
香港科技大學(科大)和中國科學院(中科院)生物物理研究所的研究人員,近日發現一種名為atlastin(ATL)的酶,原來具有運送細胞內蛋白質的功能。這項全新發現有助了解遺傳性痙攣性下身麻痺(HSP)﹕一種因神經缺陷而引致下肢痙攣的罕見遺傳性疾病背後的病理。
科學界已知ATL與導致HSP有關,但出現突變的ATL如何影響正常生理機能運作仍是一個謎。最近,由科大理學院生命科學部助理教授郭玉松領導的團隊,發現了缺乏ATL的細胞,會嚴重延緩一些重要蛋白自細胞當中被移送至細胞表面的過程,從而導致我們的生理機能失靈。團隊亦揭示了一個有趣現象,便是一種經過改造的ATL,能糾正以上的情況,為尋找此遺傳性疾病的治療方法提供了新見解。上述成果由中科院生物物理研究所胡俊傑教授的團隊共同發現。
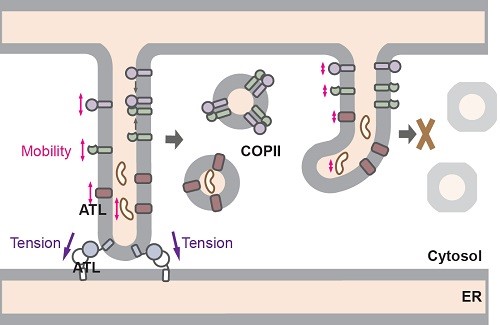
胰島素、人類抗體或依附在細胞表面負責接收訊號的蛋白,一旦在細胞中形成,便需透過分泌運輸途徑被輸送至細胞表面,以執行各項身體所需的功能。這些蛋白首先被裝載至COPII囊泡這種運輸工具之中,然後經第一站「內質網(ER)」出發,最終被傳送至細胞表面。
內質網的管狀結構由dynamin超家族蛋白atlastin(ATL)接駁而成。郭教授及其合作夥伴利用嶄新的CRISPR/Cas9技術消除ATL後,發現缺少了ATL的細胞,其內質網管道不但無法接駁得上,COPII的形成亦告減少,影響其裝載蛋白的效率。事實上,很多內質網的出口位置亦失去招募COPII載體的能力,嚴重減慢蛋白的運送速度。研究亦進一步發現,蛋白質的流動性以及COPII的形成,可透過一種經過異變、具膜栓連而非融合功能的ATL來恢復。有關研究成果近日於科學期刊《美國國家科學院院刊》中發表(https://www.pnas.org/content/early/2019/06/24/1908409116)。
郭教授指出,有關研究為ATL出錯可如何導致遺傳性痙攣性下身麻痺症提供了新見解。他表示:「很明顯, ATL介導的膜栓連在維持蛋白於內質網結構內的流動性方面保有關鍵作用,雖然我們並無相關的醫學知識制訂治療策略,但我期望是次發現可為這罕見疾病的治療方法提供線索。」
郭教授是研究細胞內部運輸方向的專家。有關研究的資金由研資局和國家自然科學基金委員會提供。
有關香港科技大學
香港科技大學(www.ust.hk)是國際知名的研究型大學,其科學、工程、商業管理及人文社會科學領域,均臻達世界一流水準。科大校園國際化,提供全人教育及跨學科研究,培育具國際視野、創業精神及創新思維的優秀人才。科大的研究於香港的大學教育資助委員會「2014研究評審工作」獲得最多「世界領先」評級,亦於最新的《泰晤士高等教育全球年輕大學排名榜2019》中排行第一,而科大的畢業生在2017年度的全球大學就業能力調查排名第12位,位列大中華院校之首。
傳媒查詢﹕
林淑媛
電話﹕2358 6313
電郵﹕anitalam@ust.hk
黃津琪
電話﹕3469 2512
電郵﹕jamiewong@ust.hk