新聞及香港科大故事
2022
新聞
科大研發新型多功能水凝膠 抑制渠務及沖廁系統的氣味及細菌
香港科技大學(科大)研究團隊研發出一種新型水凝膠,有效控制渠務及沖廁系統的氣味及細菌。氣味控制水凝膠(MOC水凝膠)能在香港不同地點包括沙井、明渠、截留器、河道及河流等,透過殺滅產生氣味的微生物抑制異味,效果得到證實。研究團隊近日研發出的新配方,更可以殺滅沖廁系統中的細菌及病毒,包括新型冠狀病毒Omicron變種株。
在創新科技署的資助下,科大與渠務署自2016年起展開合作,把水凝膠應用於不同地點的渠務設施,包括受臭味問題影響的維港海濱周邊社區。MOC水凝膠有效降低99%的硫化氫、80至90%揮發性有機物,以及80至90%的硫酸鹽還原菌(Sulfate reducing bacteria)等被視為常見的臭味來源。
這款多功能水凝膠由科大化學及生物工程學系兼環境及可持續發展學部楊經倫教授領導的團隊研發,其配方可以制定及調教,有效及安全地解決惡劣環境下的不同氣味及微生物污染問題。
創新及科技局副局長鍾偉强博士說:「科大在科研方面的努力有目共睹,我們樂見由本地大學開發的創科發明能夠應用於本地社區,改善民生。創新科技署於2011年推出『公營機構試用計劃』,資助研發成果於公營機構和政府部門內進行試用。計劃同時能夠為試用的公營機構或政府部門配對合適的科技產品或方案,鼓勵它們更廣泛地採用創新科技,創造出雙贏局面。政府會繼續發揮推動者及促進者的角色,透過不同的政策及資助計劃協助研發機構將科研成果商品化。」
楊教授指出,在應對氣味問題上,MOC水凝膠是一個經濟實惠但成效顯著的解決方法。MOC水凝膠安全、環保及具可持續性,可以與傳統清理渠道及清淤工作相輔相成。他說:「MOC水凝膠除了可以殺滅產生氣味的微生物以抑制異味,研究亦證實它可以防止渠道受到侵蝕及抑制耐藥性細菌。另外,水凝膠在釋出消毒劑後會分解成沙,所以不會對環境造成損害。」
新聞
科大積極推動神經退行性疾病早期診斷及基因治療研究
香港神經退行性疾病中心(Hong Kong Center for Neurodegenerative Diseases,簡稱HKCeND)由香港科技大學(科大)成立,其研究團隊在阿爾茲海默症(AD)的早期診斷和治療方面取得了重大突破,有望為疾病管理帶來變革。團隊已建立了先進的生物標誌物開發平台,識別出新型的血液生物標誌物,並設計了一套創新的人工智能AD評分系統,可用於預測罹患AD的風險,早期診斷以及劃分患病的階段。團隊還成功研發新型基因治療策略,有助治療阿爾茲海默症。
HKCeND於2020年成立,獲香港特區政府的InnoHK 創新香港研發平台提供5億港元起始資金支持,致力推動神經退化性疾病研究及科研成果轉化,以發展成爲世界領先的科研中心。HKCeND的跨學科研究團隊,由來自科大、倫敦大學學院及史丹福大學醫學院的國際知名科學家組成,正合作展開一系列前沿研究,包括研發新型生物標誌物、識別治療靶點和系統因素,以及推動神經退化性疾病診療方法的發展。
AD是一種嚴重的神經退行性疾病,也是最常見的認知障礙症,至今仍未有有效的治療方法。這種不治之症正影響全球超過五千萬人口。目前,AD的診斷和治療面臨巨大挑戰。患者常在病情進入晚期、出現記憶喪失等症狀時,方獲確診。事實上,患者在病徵出現前至少10-20年已經患上了AD。因此,早期診斷至關重要。當患者出現輕度或早期認知障礙時,及早發現有助他們及時進行健康管理和干預,改善治療效果。研究發現,生物標誌物對於阿爾茲海默症早期診斷具有重要作用。
新聞
科大發現音猬因子胞內分泌轉運的分子機制 有助研發相關癌症的治療方案
香港科技大學(科大)發現了哺乳類動物中調控音猬因子(Shh)分泌的機制,加強了解這個能影響癌症進程的重要信號因子,為研發相關癌症的治療方案提供新的思路。
音猬因子參與調節生物體生長發育中的多個關鍵環節,包括細胞增殖和分化、胚胎發育、體節形成、組織內穩態平衡及再生等。Shh信號通路相關突變及缺陷會導致癌症的發生,Shh在癌細胞的生長和遷移中也起著關鍵作用。目前所有的Shh 信號通路抑制劑都針對於 Shh 與目標細胞表面受體結合之後的下游通路中的蛋白。然而,這些抑制劑對於治療配體依賴型的癌症效果並不顯著。
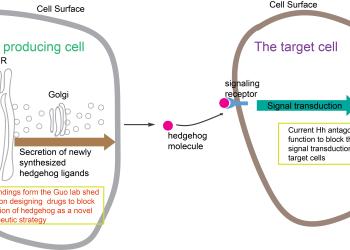
新合成的Shh沿著分泌轉運途徑被傳遞至質膜釋放到細胞外基質後,被靶細胞表面受體識別,從而激活下游信號通路。由科大生命科學學部副教授郭玉松領導的研究發現,貨物受體蛋白SURF4和蛋白多糖以接力的方式調控Shh從內質網到高爾基體的運輸,為Shh的合成轉運途徑的分子機制提供新的見解,並且為設計Shh 信號通路抑制劑治療癌症提供新的方案。
可溶性貨物蛋白比如胰島素和音猬因子在核糖體合成出來後,必須通過分泌轉運途徑分泌到細胞外基質才能夠行使其生理功能。儘管這個過程非常重要,但是其分子機制大部分未為科學家所知。分析這一至關重要的細胞過程的兩個主要障礙是:使用傳統的實驗方法很難直接定量分析將貨物蛋白質包裝到運輸囊泡中的效率;這些可溶性貨物蛋白一旦被細胞合成後就被細胞分泌出去,因此在常態下很難對這些可溶性貨物蛋白的運輸做精準的細胞內部定位分析。
為了克服這些問題,團隊通過體外囊泡重組法重構了音猬因子在分泌途徑中被篩選入運輸囊泡的過程,並採用高效同步化的蛋白運輸系統(RUSH轉運法)使得音猬因子從內質網的同步化輸出受控於生物素的調控(錄像1)。通過這些獨特的方法以及其他的細胞分子生物學手段,研究闡明了Shh的胞內轉運通過以下幾個步驟調控:
新聞
用電話給自己把脈
用手機掃描一下,30秒便得出一系列健康數據。
新冠疫情肆虐全球,徹底改變了世界原來的樣貌,商界需要迅速應變以適應新常態,香港初創公司PanopticAI 也是其中之一。創辧人覷準市場在社交距離限制下,人們對遙距診斷及自我診斷的需求大增,因此積極拓展相關科技的應用。
智能手機監察健康
團隊利用人工智能技術,研發了一個全遙距的健康監測程式,與坊間利用LED感應的健康監測手錶不同,PanopticAI的程式可連接到使用者的智能手機、平板電腦或電腦鏡頭,測量使用者皮膚上出現的輕微顏色變化,從而計算血流量,再得出一系列的健康數據。
公司行政總裁黃君朗說:「在網上就診前,使用者只需用手機掃描一下,30秒左右便得出反映個人生命跡象的一系列數據。」
這些數據包括心跳、呼吸頻率、血壓、血氧濃度和心跳變異度;程式還會利用團隊研發的視像掃描演算法,根據收集得到的數據推算出使用者的壓力指數、能量水平和健康風險因素等結果。
君朗目前正在科大攻讀生物工程學博士課程,他參與的研究團隊在2018年起與政府合作,在邊境口岸和政府辦公室等設立智能體溫監測系統。PanopticAI就是君朗與團隊成員在研究期間同時創立,另外三位聯合創辦人都是來自科大,包括工業工程和物流管理博士陳經緯、工業工程及決策分析學哲學碩士陳子泰,以及負責帶領研究小組的工程學院教授蘇孝宇。