新闻及香港科大故事
2023
新闻
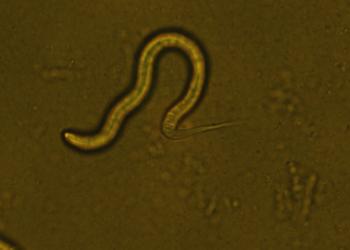
解构秀丽隐杆线虫pri-miRNA加工复合体的分子机制
小分子核糖核酸(microRNAs,以下简称miRNAs)是一种在动物和人类基因调控中发挥重要作用的小型核糖核酸(RNA),一直令许多科学家为之着迷。在生物学和医学中,一項非常重要的研究范畴就是miRNA如何控制和调节基因表达,因为科学界一般相信,这个课题对理解细胞突变有重大作用,对於治疗癌症和其他与细胞突变有关的疾病,至为关键。
虽然miRNA及其在人类中的生物起源已是科学界的热门题目,但针对其他动物中的miRNA加工复合体(一种启动miRNA生物起源的蛋白质复合物)的研究却相当缺乏。最近,香港科技大学(科大)的研究团队揭示了秀丽隐杆线虫加工复合体(cMP)的基本机制,该研究为未来线虫中miRNA相关研究铺平了道路,并为探索miRNA在所有生物中发挥的作用,提供更广泛的视觉。
该研究最近在开放获取期刊Nucleic Acids research上发表。
领导这项研究的科大生命科学部助理教授阮俊英教授说:「秀丽隐杆线虫加工复合体(cMP)的分子机制自18年前发现以来,一直没有详细阐明。当然,出于充分的理由,许多人关注于人源miRNA的研究,但是对于秀丽隐杆线虫中这种复合体卻缺乏基本信息,所以引发了我們的研究。」
新闻
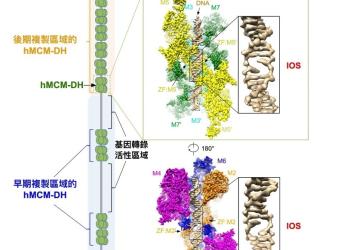
研究揭示DNA解旋机制 为癌症治疗带来新曙光
香港科技大学(科大)联同香港大学(港大)与法国居礼研究所共同发现了人体MCM2至MCM7蛋白复合体(Minichromosome Maintenance 2-7,微小染色体维持蛋白2-7)调控DNA 复制起始(Replication Initiation)的新机制。 此发现可被应用于研发新型、高效及更具针对性的抗癌药物。这项研究成果现已刊登在国际顶尖科学期刊《细胞》杂誌上(按此浏览期刊文章)。
我们的生命由单个受精卵细胞形成时开始。在母体子宫内,受精卵通过细胞分裂而发育成多细胞个体。在每次分裂中,编码遗传信息的基因组DNA都会被准确复制。每个细胞携带的DNA总长度约为两米,其通过摺叠、整合成为23对染色体。在人的一生中(约70年),人体将合成接近一光年长度的DNA(10^16米)。在复制的过程中,首先须利用解旋酶将双链DNA分解成两条单链DNA,其后DNA聚合酶以此为模板,合成两条新的互补配对的双螺旋DNA。若调控过程中出现一丝紊乱,都可能导致严重后果,例如肿瘤或遗传疾病等。
「破解DNA复制的机制是认识生命奥秘的关键。」领导这项研究的港大生物科学学院助理教授翟元樑博士说。「而解析复制机器蛋白质结构是了解其分子功能最核心的步骤,因为只有亲眼看到,才能相信。」
2022
新闻
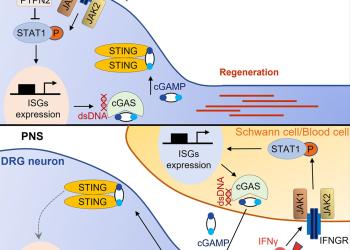
研究发现促进成年神经系统轴突再生的内在免疫机制
中枢神经系统一旦受创,例如在脊髓损伤的意外中,伤者很可能会永久丧失感觉或活动能力,当中的关键原因,是轴突断裂后无法再生。目前,医学界为脊髓损伤患者恢復活动能力的方法非常有限。若要为他们带来治疗希望,其中一个研究方向,便是要破解令这些受伤轴突再生的方法。
由香港科技大学(科大)生命科学部郑氏理学副教授刘凯带领的团队,用老鼠进行实验,解构了促进神经突轴再生的部分原理。他们发现,通过敲除神经元内编码一种磷酸酶的基因PTPN2,可以促进中枢神经系统的轴突重生,另外,若再外加Ⅱ型干扰素IFNγ,更可进一步提升再生的轴突数量和生长速度。这项研究的结果,最近于科学期刊Neuron上发表。
人类的神经系统可分为两部分:中枢神经系统和外周神经系统。与中枢神经系统的分别是,外周神经当受到损伤时,具有较强的再生和自我修復能力 。不过,科学界一直并未完全了解这个再生和修復过程与神经系统内在免疫机制以及免疫相关的细胞因子的关係,包括一些信号通路如何影响受伤的神经元,以及它们能否直接促进轴突再生。
是项研究亦探索了IFNγ-cGAS-STING信号通路有否参与外周神经的自我修復过程。团队发现,外周神经轴突可以在损伤后,直接调节其损伤环境中的免疫反应,以促进自我修復。
在过往的研究中,刘教授的团队已经发现,可以通过提高神经元电活动,改变神经元甘油脂代谢途径等不同方法,从而加强轴突的再生能力。今次这项研究,为脊髓损伤这类情况的未来治疗方案,找到进一步线索,比如联合几种不同的信号通路可以大幅提高神经再生。

新闻
国家主席习近平视察科大香港神经退行性疾病中心
国家主席习近平昨天在一众中央及香港特区政府官员陪同下,视察位于科学园的香港神经退行性疾病中心。中心主任兼香港科技大学(科大)晨兴生命科学教授叶玉如教授向习近平主席介绍中心的科研项目及成果,包括能及早筛查并识别阿尔兹海默症患者的简易血液检测方法,以及相关的干细胞研究。
香港神经退行性疾病中心由科大牵头于2020年成立,为世界领先的科研中心,获香港政府InnoHK创新香港研发平台提供5亿港元起始资金支持,致力推动神经退化性疾病研究及科研成果转化。叶教授昨日亲自向习近平主席介绍中心与阿尔兹海默症的相关研究,习主席对有关介绍十分感兴趣,详细了解研究的进展、技术优势,以及未来的临床应用等。
叶教授对习主席视察中心感到非常荣幸,指习主席重视香港的创科发展。她说﹕「中国估计有1,000万阿尔茨海默症患者,是全球最高,而这个数字还会随着人口老龄化继续增长。可以预见,这种疾病为国家社会和经济发展带来重大影响。习主席对我们的研究成果表示肯定,称赞我们的研究工作有重要意义。他勉励我们尽快将科研成果转化成应用,加强与内地科研合作,切实为国家和香港的健康事业做出贡献。」
叶教授续指﹕「我们中心的研究人员对于习主席到访感到非常荣幸,也深受鼓舞。未来会牢记习主席的殷切嘱托,奋力前行,加快我们的科研转化工作,积极参与国家建设,为社会带来裨益。」
结束视察前,习近平主席向30多名香港科研人员和青年创业者代表发表讲话,勉励科研人员、业界及青年,特别是对香港青年的关心,体现对香港创科的重视和肯定,对香港贡献国家科技发展的期盼。
新闻
科大积极推动神经退行性疾病早期诊断及基因治疗研究
香港神经退行性疾病中心(Hong Kong Center for Neurodegenerative Diseases,简称HKCeND)由香港科技大学(科大)成立,其研究团队在阿尔兹海默症(AD)的早期诊断和治疗方面取得了重大突破,有望为疾病管理带来变革。团队已建立了先进的生物标志物开发平台,识别出新型的血液生物标志物,并设计了一套创新的人工智能AD评分系统,可用于预测罹患AD的风险,早期诊断以及划分患病的阶段。团队还成功研发新型基因治疗策略,有助治疗阿尔兹海默症。
HKCeND于2020年成立,获香港特区政府的InnoHK 创新香港研发平台提供5亿港元起始资金支持,致力推动神经退化性疾病研究及科研成果转化,以发展成为世界领先的科研中心。HKCeND的跨学科研究团队,由来自科大、伦敦大学学院及史丹福大学医学院的国际知名科学家组成,正合作展开一系列前沿研究,包括研发新型生物标志物、识别治疗靶点和系统因素,以及推动神经退化性疾病诊疗方法的发展。
AD是一种严重的神经退行性疾病,也是最常见的认知障碍症,至今仍未有有效的治疗方法。这种不治之症正影响全球超过五千万人口。目前,AD的诊断和治疗面临巨大挑战。患者常在病情进入晚期、出现记忆丧失等症状时,方获确诊。事实上,患者在病征出现前至少10-20年已经患上了AD。因此,早期诊断至关重要。当患者出现轻度或早期认知障碍时,及早发现有助他们及时进行健康管理和干预,改善治疗效果。研究发现,生物标志物对于阿尔兹海默症早期诊断具有重要作用。
新闻
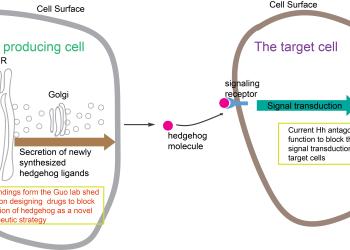
科大发现音猬因子胞内分泌转运的分子机制 有助研发相关癌症的治疗方案
香港科技大学(科大)发现了哺乳类动物中调控音猬因子(Shh)分泌的机制,加强了解这个能影响癌症进程的重要信号因子,为研发相关癌症的治疗方案提供新的思路。
音猬因子参与调节生物体生长发育中的多个关键环节,包括细胞增殖和分化、胚胎发育、体节形成、组织内稳态平衡及再生等。Shh信号通路相关突变及缺陷会导致癌症的发生,Shh在癌细胞的生长和迁移中也起着关键作用。 目前所有的Shh 信号通路抑制剂都针对于 Shh 与目标细胞表面受体结合之后的下游通路中的蛋白。然而,这些抑制剂对于治疗配体依赖型的癌症效果并不显著。
新合成的Shh沿着分泌转运途径被传递至质膜释放到细胞外基质后,被靶细胞表面受体识别,从而激活下游信号通路。由科大生命科学学部副教授郭玉松领导的研究发现,货物受体蛋白SURF4和蛋白多糖以接力的方式调控Shh从内质网到高尔基体的运输,为Shh的合成转运途径的分子机制提供新的见解,并且为设计Shh 信号通路抑制剂治疗癌症提供新的方案。
可溶性货物蛋白比如胰岛素和音猬因子在核糖体合成出来后,必须通过分泌转运途径分泌到细胞外基质才能够行使其生理功能。尽管这个过程非常重要,但是其分子机制大部分未为科学家所知。分析这一至关重要的细胞过程的两个主要障碍是:使用传统的实验方法很难直接定量分析将货物蛋白质包装到运输囊泡中的效率;这些可溶性货物蛋白一旦被细胞合成后就被细胞分泌出去,因此在常态下很难对这些可溶性货物蛋白的运输做精准的细胞内部定位分析。
为了克服这些问题,团队通过体外囊泡重组法重构了音猬因子在分泌途径中被筛选入运输囊泡的过程,并采用高效同步化的蛋白运输系统(RUSH转运法)使得音猬因子从内质网的同步化输出受控于生物素的调控(录像1)。通过这些独特的方法以及其他的细胞分子生物学手段,研究阐明了Shh的胞内转运通过以下几个步骤调控:

新闻
科大研究人员研发长期活体成像技术用于脊髓损伤研究和治疗
由香港科技大学(科大)科学家们所领导的研究团队研发出一种新型活体成像技术用于观察脊髓损伤和修复的重要生物过程,从而为更好的理解脊髓损伤的病理以及开发相应的治疗方案打下基础。
脊髓作为人体大脑和周围神经的主要信息传输通路,内含紧密排列的神经束和胶质细胞。脊髓损伤往往造成毁灭性及无法逆转的神经创伤,从而可能导致终身残疾和瘫痪,无法治愈。
通过成像来了解脊髓的功能及其对于病理性损伤以及治疗方案的反应是十分重要的,然而现今并没有有效的成像手段,可以在不引起脊髓免疫反应的情况下对脊髓进行细胞水平的生物观察。传统的成像手段需要将实验对象的脊髓暴露出来以提升图像的分辨率,这往往引起脊髓组织的免疫反应,从而影响所研究疾病的自然发展过程,对疾病研究产生干扰。
如今,由科大电子及计算机工程学系教授瞿佳男和生命科学部副教授刘凯领导的研究团队展示了一种新的活体脊髓成像方法,实现了对小鼠脊髓长期,多次,稳定,高分辨率且无免疫反应干扰的光学成像。
在他们的方法中,相邻两节椎骨的缝隙被作为窗口进行成像,同时他们保留了背侧连接相邻两节椎骨的黄韧带组织而不是将脊髓完全暴露。保留这层韧带结构使得成像手术引起免疫反应的风险大大降低,但同时也降低了成像质量:因为这层韧带组织会带来光学散射,并降低了光学成像的穿透深度。







