科大研究揭示短距離囊泡運輸機制
香港科技大學(科大)的研究團隊揭示囊泡在細胞內局部區域進行短距離運輸的機制,為這個生物學家尚未充分認識的領域提供了新方向。
囊泡是一個小的細胞容器,可以執行多種生物功能,包括轉運蛋白質、脂質、以及生物體生存所需的其他物質,並回收廢料。除了使用馬達蛋白進行長距離運輸外,細胞還有在特定區域進行短距離囊泡運輸的需求。 然而,這種短距運輸的確切機制仍待科學家進行研究。
為了應對這項挑戰,一支由科大生命科學部博士研究生裘驊先生及研究資助局博士後研究員吳先登博士所帶領的研究團隊,在科大前生命科學部講座教授張明傑和科大生命科學部教授鄔振國的指導下,聚焦於突觸囊泡(SVs)的研究,成功揭開了短距離運輸的神秘面紗。他們發現,這些與囊泡相關的特定蛋白質的相分離,能夠使囊泡在細胞的不同區域之間以可控的方式移動。
具體而言,一種名為Piccolo的巨型條狀蛋白質,可以響應鈣訊號,從儲備池(reserve pool)提取突觸囊泡,並將它們運送到活躍區域(Active zone)。
他們還發現,另一種名為TFG的蛋白質也透過使用類似的相分離過程,協助囊泡從內質網(ER)運送到內質網-高爾基體中間體。
科大及理大研究人員開發體外囊泡重組實驗 為研究蛋白分泌轉運途徑的分子機制提供新見解
香港科技大學(科大)及香港理工大學(理大)研究人員開發了體外囊泡重組實驗,並通過結合該實驗途徑及定量質譜分析,發現了囊泡中受特定因子調控被裝入囊泡的特定貨物蛋白,和介導囊泡運輸的新的調控蛋白。該研究成果及實驗途徑,為進一步揭示分泌途徑相關的分子機制提供了重要的新工具。
真核細胞的分泌轉運途徑是一個非常重要的過程。人體內的很多生長因子,荷爾蒙以及其他重要的因子都是通過分泌轉運途徑從細胞中分泌出來,從而履行它們的生理功能。另外很多新合成的蛋白必須通過分泌轉運途徑以被運輸到特定的亞細胞目標位點才能行使其功能。在分泌轉運途徑中承載貨物蛋白的運輸工具是運輸囊泡。就像日常生活中的物流及運輸服務,貨物蛋白是否能夠被運輸到正確的靶向位點,關鍵在於這些貨物蛋白是否被準確分選到特定的運輸囊泡中。若貨物蛋白分選功能缺失,會導致細胞極性建立、免疫功能以及其他生理功能缺陷。
科大研究團隊破解重要的分子機制 為癌症藥物開拓新方向
香港科技大學(科大)的研究人員揭示了平面細胞極性(Planar cell polarity,下稱PCP)中,控制核心蛋白傳送的分子機制。平面細胞極性是人體內調節細胞生長及活動的一個重要過程;有關研究將對開發癌症新藥物提供有用線索。
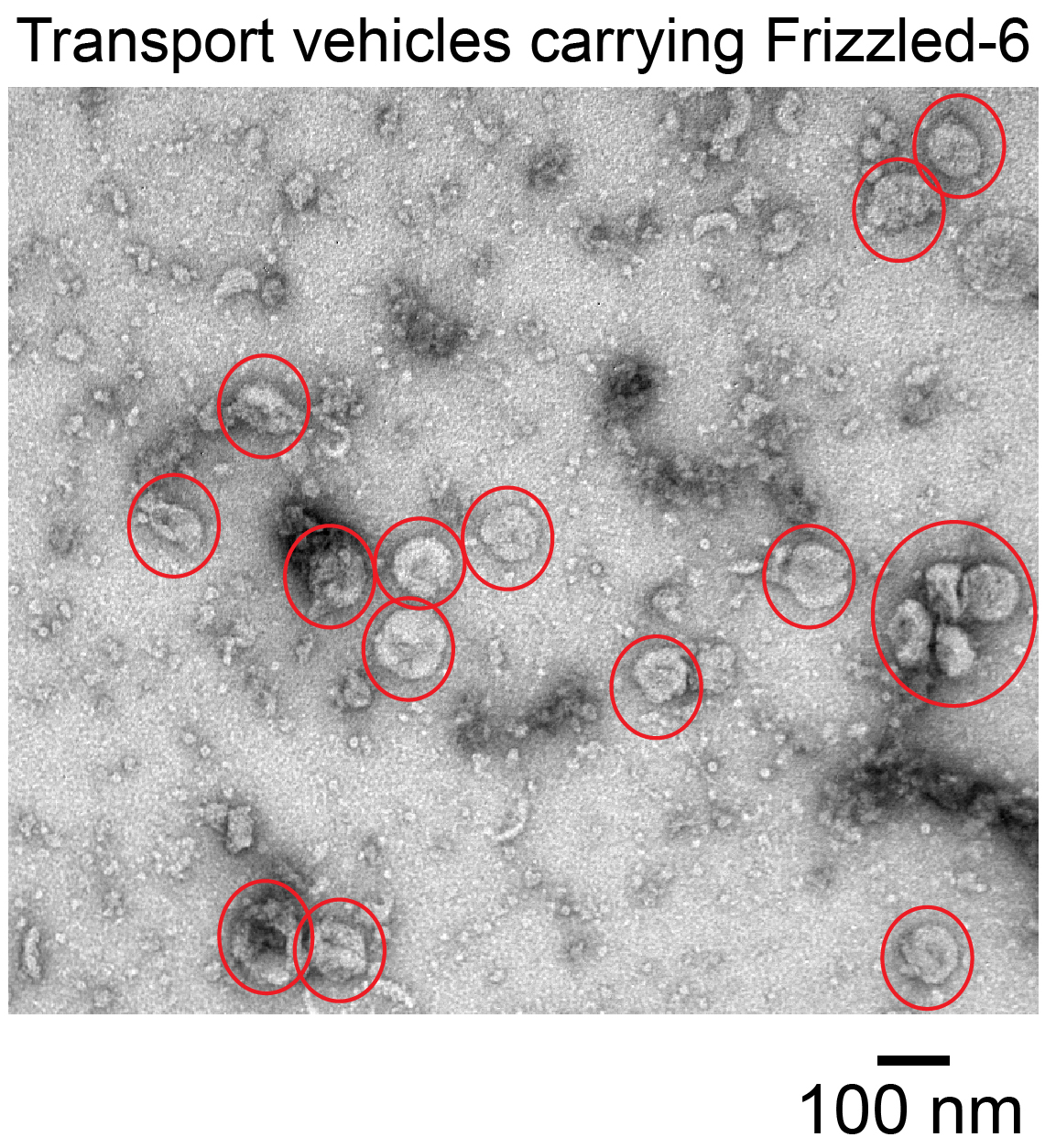
PCP是一個對人體組織發展及器官運作起著關鍵作用的生物過程。PCP機制出錯,會導致人體出現神經系統失調、骨骼發育異常或先天性心臟病等。更壞的情況是,癌細胞可奪取並利用PCP這個機制,促使其生長及擴散。
科大研究團隊揭示新病毒特徵 或有助對抗全球暖化和研製抗病毒藥物
全球暖化以及溫室氣體排放讓海洋中的含氧量在過去數十年間持續下降1,污染並破壞我們的生態系統。為了遏止這個趨勢,香港科技大學(科大)的研究團隊發現一種機制,有望提升一種環保水生細菌清除二氧化碳的能力,為海洋生產更多氧氣。
儼如陸地上的樹木,藍綠藻(又名藍細菌)於海洋進行光合作用,為海洋生物提供氧氧,地球逾20%的二氧化碳都是經由它們所吸取。可是,全球每天有近半的藍綠藻,因被捕食或受病毒感染而死亡,當中單是一種名為噬藻體的病毒,每日便殺死達全球總量五分之一的藍綠藻。
科大海洋科學系副教授曾慶璐領導的研究團隊歷時五年,最近終於揭示噬藻體殺死這環保細菌,亦即其宿主(host)的規律,所倚賴的是宿主進行光合作用時所產生的能量。團隊利用實驗室培植的噬藻體進行研究,發現牠們於黑暗環境中,並不能完全發揮感染宿主的功能,但藍綠藻卻偏偏在晚上被牠們殺死。原來在日照時份,藍綠藻透過光合作用所生產的能量,會成為噬藻體用作感染其宿主的燃料-令噬藻體在日間完成所有足以破壞藍綠藻細胞結構的感染過程,使其終在晚上分崩離析。很多生物,包括日出而作、日入而息的人類,都具有晝夜節律,但今次研究首次發現,原來病毒亦具有晝夜節律。
香港科技大學研發新型顯微鏡 可拍攝活細胞立體影像 開闢細胞生物學研究新時代
香港科技大學(科大)一支科研團隊研發出新一代顯微鏡,不但能為活細胞拍出立體影像,並且所拍攝的畫面質素亦更高,大大擴闊了細胞生物學可研究的範圍及提升準確性。
雖然現存的共聚焦顯微鏡也可拍攝出立體生物細胞圖像,但是由於其照射在細胞樣本上的激光,較盛夏的陽光還要強100萬倍,其強烈的曝光量往往破壞細胞的活力,並將之殺死,細胞生物學研究因而一直受到限制。
由科大杜勝望教授及雷明德教授團隊所研發的新型線性貝塞爾光片(LBS)顯微鏡,其光毒性則僅有目前共聚焦顯微鏡的千分之一,從而大大延長了被觀測細胞的壽命,讓科學家得以進行更仔細的觀察。光毒性是一種由光引起的敏感性,可導致分子變化。另外,新顯影技術的速度亦較共聚焦顯微鏡快1,000倍,拍攝出來的畫面因而更為清晰連貫,有助研究人員更準確及有效率地研究蛋白質於細胞中運行的軌跡,了解細胞變異的情況。杜教授是科大物理學系和化學及生物工程學系教授,亦是超分辨率影像中心副主任。雷教授則是科大物理學系榮休教授。
杜教授表示:「新型線性貝塞爾光片(LBS)顯微鏡是一項高精密的科學與工程技術,我們將此技術之操作簡化,讓研究人員不必經過特別培訓,便懂得如何使用。我們的技術突破限制,讓科學家得以接觸細胞底蘊,我期望透過提升研究人員對細胞的理解,能有助他們解開某些疾病的成因與演變。」
諾貝爾生理學或醫學獎得主蘭迪·謝克曼博士於「科大25周年傑出人士講座系列」講解大粒子分泌及微RNA
香港科技大學(科大)於5月27日舉辦「科大25周年傑出人士講座系列」,由2013年諾貝爾生理學或醫學獎得主蘭迪·謝克曼博士擔任主講嘉賓。科大師生踴躍參與講座,反應熱烈。
謝克曼博士以「大粒子分泌及微RNA」為題,向聽眾解釋他的最新研究結果。在第一部分的報告中,謝克曼博士講述了如何將大型蛋白質「膠原蛋白原」裝入COPII囊泡內,這是膠原蛋白原分泌的重要一環。謝克曼博士發現籠狀蛋白聚合物COPII的一個亞基Sec31的泛素化作用會促進大的COPII結構形成,從而加快膠原蛋白原由內質網的傳輸。
謝克曼博士說:「透過使用先進的成像和改良的免疫學檢測,我們能確定大的COPII結構會依賴E3泛素連接酶的一個亞基klhl12的表達,捕捉膠原蛋白原。」
謝克曼博士亦介紹一種透過外泌體分泌特定微RNA的一個途徑。外泌體是細胞衍生的囊泡,在很多過程如製造腫瘤細胞擴散的細胞轉移前微環境中扮演重要角色。謝克曼博士講解了一種生物化學的方法以分離特異的外泌體。通過這種方法,謝克曼博士研究團隊揭示了一系列這些分離出來的外泌體所包含的特定的微RNA,其中包括miR-223。謝克曼博士亦解釋將miR-223裝入外泌體的分子機制。
香港科技大學及美國史拔思科研院科學家 發現蛋白酶變體可作為新蛋白質藥物製劑
香港科技大學賽馬會高等研究院(高研院)和美國史拔思科研院發展實驗室(科大高研院─史拔思科研發展實驗室)聯合研究小組與aTyr製藥公司發現一類蛋白合成酶在人類生命活動中具有重要的新功能。這項研究不僅發現了250個全新及可能影響幹細胞以至免疫系統功能的蛋白質,也揭示了生命進化過程中蛋白質演化的重要性,同時也為研發蛋白質藥物製劑提供了新的方向。這一重大研究已於2014年7月18日出版的國際權威雜誌《科學》發表。
領導聯合研究團隊的Paul Schimmel教授指出:「這一研究成果中所發現的全新剪接變體蛋白質揭示了以往於生物研究中從未被發現和觸及的領域,為科學家進一步探討生命和進化過程邁進了一大步。」Paul Schimmel教授為加州及佛羅里達州史拔思科研院的Ernest and Jean Hahn教授,並於2008年出任科大高研院訪問教授。






