科大破解人類口腔微生物小分子促進牙菌膜形成的奧秘
為預防蛀牙開闢新途徑
(這篇文章於2021年3月16日在EurekAlert!上刊出)
由香港科技大學(科大)海洋科學系及生命科學部講座教授錢培元帶領的一支跨學科研究團隊,揭示了人類口腔變形鏈球菌(Streptococcus mutans)釋放出的新型微生物小分子與蛀牙的形成有關,為人類口腔微生物群對健康的影響提供了新的科學證據,推動了未來預防蛀牙的研究。該研究成果已發表在權威前沿科學雜誌Nature Chemical Biology,並獲Nature以亮點研究進行報道。
生物膜(biofilm)是由細菌胞外大分子包裹的細菌群體組成;地球上每一個濕潤的表面都被生物膜所覆蓋。美國國家衛生研究院(National Institutes of Health)早期研究表明,超過80%的人類細菌感染是由生物膜引起的。 變形鏈球菌是生存在人類口腔的主要天然菌,它可以形成生物膜和產生有機酸,所以一直被認為是導致蛀牙的主要原因。
蛀牙一向被列為是人類最常見的慢性細菌感染疾病之一,且治療費用昂貴。全球每年用於治療蛀牙的經濟支出高達數十億美元1 。蛀牙的發展是一個複雜的過程,主要依賴於牙齒表面微生物生物膜(又稱為牙菌膜)的形成。雖然變形鏈球菌中與生物膜形成和發展有關的大分子已被廣泛研究,但小分子次生代謝產物在這種細菌生物膜形成中的作用仍未被深入探究。
錢教授的研究團隊致力於運用基因組學、轉錄組學和化學生物學的方法,研究生物膜的訊號分子如何調控微生物及動物間的相互作用。最近,該團隊將生物膜研究拓展到公共衛生領域。
通過與美國加州大學伯克利分校張文君教授、Roya MABOUDIAN教授和美國佛羅里達大學口腔學院的Robert BURNE教授合作,研究團隊從臨床牙菌膜分離的變形鏈球菌菌株中發現了一種聚酮/非核糖體肽生物合成基因簇muf,該基因簇與生物膜形成能力的增強直接相關。隨後,他們發現了與muf有關的具有新型分子骨架結構的生物活性產物——mutanofactin-697。進一步的研究揭示這種獨特的微生物次級代謝物,是透過一種前所未有的理化機制(physiochemical mechanism) 引致生物膜的形成:該小分子通過與變形鏈球菌細胞和胞外DNA結合來增加細菌的疏水性,進而促進細菌黏附和生物膜的形成。
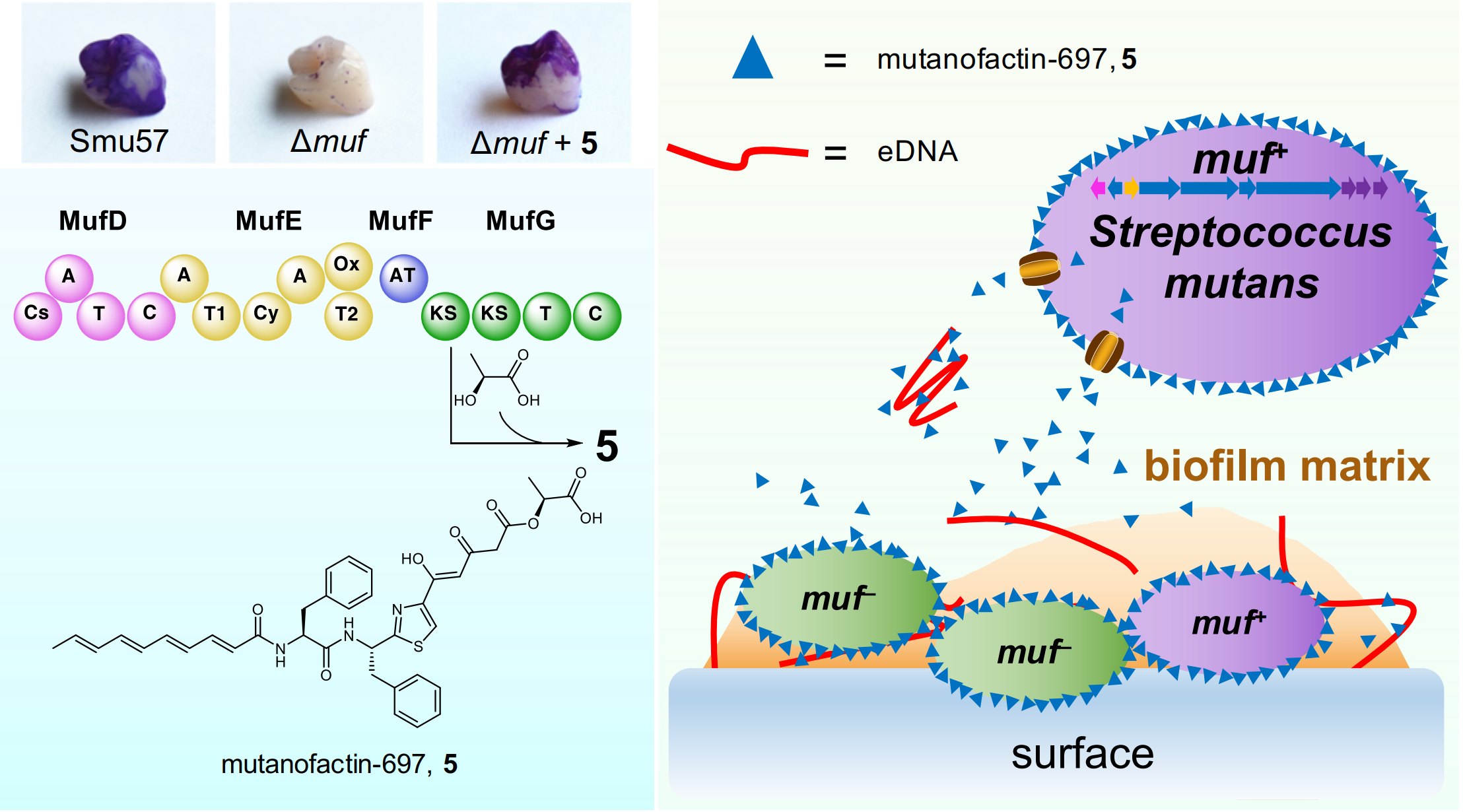
本身亦為科大捷成David von Hansemann 理學教授的錢教授表示:「我們首次發現了微生物次生代謝產物是通過理化機制促進生物膜形成,突出了次生代謝產物在形成蛀牙的關鍵過程中發揮的作用及重要性。」
硏究團隊中的李忠瑞指出,這一發現將推進人類口腔生態中有關mutanofactin化學調控過程的研究,以及鏈球菌引起的蛀牙及相關預防機制的探索。
1全球口腔健康造成的經濟負擔達4 420億美元
https://www.nature.com/articles/bdjteam2015148











